Содержание
- 1 схема и принцип действия pH-метра
- 2 Правила работы с рН-метром
- 3 pH-метр
- 4 2. Принцип работы pH-метра
- 4.1 2.3.4 Принцип работы установки для алкилирования изобутана изобутиленом
- 4.2 fПринцип и схема метода
- 4.3 13.2 Принцип Ле Шателье
- 4.4 f2. Принцип изотахофореза
- 4.5 fПринцип работы водоочистных систем, работающих на основе процесса обратного осмоса
- 4.6 2.1 Принцип действия ферментов
- 4.7 2.3 Принцип работы дифференциального (автоматического) титрометра
- 4.8 f2. Принцип работы аккумуляторной батареи
- 4.9 f1.2 Принцип работы ректификационного аппарата
- 4.10 2.1.1 Принцип метода
- 4.11 f6.Принцип оптимизации технологии
- 4.12 Экстракторы. Классификация. Принцип работы
- 4.13 2.1 Принцип метода
- 4.14 Принцип работы дифрактометра и метод Дебая — Шеррера
схема и принцип действия pH-метра
Действие pH-метра основано на измерении величины ЭДС электродной системы, которая пропорциональна активности ионов водорода в растворе — pH (водородному показателю).
- Измерительная схема по сути представляет собой вольтметр, проградуированный непосредственно в единицах pH для конкретной электродной системы (обычно измерительный электрод — стеклянный, вспомогательный — хлорсеребряный).
Входное сопротивление прибора должно быть очень высоким — входной ток не более 10−10А (у хороших приборов менее 10−12А), сопротивление изоляции между входами не менее 1011Ом, что обусловлено высоким внутренним сопротивлением зонда — стеклянного электрода. Это основное требование к входной схеме прибора.
Компенсационный метод измерения, ЭДС
ЭДС измерялась компенсационным методом с помощью потенциометра и чувствительного гальванометра. Когда схема в равновесии, ток через гальванометр не течёт, и нагрузка на электроды не действует — по шкале потенциометра корректно отсчитывается ЭДС. Так же применялся метод с баллистическим гальванометром. Сначала от электродов заряжался конденсатор, затем он разряжался на рамку гальванометра, максимальное отклонение которой пропорционально заряду конденсатора, а следовательно — напряжению.
Далее появились приборы с входным усилителем на электронных лампах. Специальные («электрометрические») лампы имеют ток утечки сетки порядка пикоампер, что позволяет получать большие входные сопротивление. Недостатком таких схем является большой дрейф и уход калибровки из-за неизбежного старения и изменения характеристик лампы.
Решить проблему дрейфа и одновременно высокого входного сопротивления позволили компенсационные схемы с усилителем, построенным по принципу модулятор — демодулятор. Механический ключ (вибропреобразователь) поочерёдно соединяет небольшой конденсатор с входом и цепью обратной связи.
Если постоянные напряжения на них отличаются, то через конденсатор протекает небольшой переменный ток, который создаст переменное напряжение на сеточном резисторе входной лампы.
Далее пульсации усиливаются несколькими каскадами, и поступают на фазочувствительный демодулятор (в простейшем случае — такой же вибропреобразователь, электромагнит которого включён параллельно электромагниту первого). На выходе получается напряжение, пропорциональное разности напряжений на входе.
Цепь обратной связи (резистивный делитель) задаёт общий коэффициент усиления, стремясь поддерживать на входе усилителя нулевую разность напряжений. Эта схема практически лишена дрейфа, усиление мало зависит от степени износа ламп. Снижается требования к самим лампам — вместо дорогих электрометрических можно применять массовые приёмно-усилительные лампы. Так работает, например, отечественный прибор pH-340.
В более поздних моделях вместо контактного преобразователя применялся динамический конденсатор, позднее ключ на фотосопротивлении, освещаемом импульсами света (например иономер ЭВ-74), а лампы на входе сменились полевыми транзисторами.
В настоящее время большинство прецизионных операционных усилителей с входом на полевых МОП-транзисторах, и даже простейшие АЦП удовлетворяют требованиям по входному сопротивлению.
Так как ЭДС электродной системы сильно зависит от температуры, то важной является схема термокомпенсации.
Изначально применялись медные термометры сопротивления, включённые в сложные мостовые схемы обратной связи, или потенциометр со шкалой в градусах, ручкой которого устанавливали значение температуры, измеренное ртутным термометром.
Такие схемы имеют большое число подстроечных резисторов и крайне сложны в настройке и калибровке. Сейчас датчик температуры работает на отдельный АЦП, все необходимые корректировки вносит микроконтроллер.
Зависимость напряжения от pH (для системы со стеклянным и хлорсеребряным электродами) следующая
Большинство современных стеклянных электродов делают так, чтобы в паре с хлорсеребряным ЭДС была примерна равна нулю при pH = 7, то есть в нейтральной среде.
При основном (щелочном) pH, (но, обычно, не более 14 — предел для стеклянных электродов) напряжение на выходе датчика варьируется от 0 до −0,41В ((14-7)* −0,059 = −0,41).
Например, pH 10 (на 3 ед. выше нейтрального), (10-7) * −0,059 = −0,18В).
При кислотном pH, напряжение на выходе датчика колеблется от 0 до +0,41В. Так, например, pH 4 (3 ед. ниже нейтрального), (3-7)* −0,059 = +0,18В.
Две главные настройки выполняются при калибровке по буферным растворам с точно известным значением pH — устанавливается крутизна усиления и смещение нуля. Так же настраивается так называемая изопотенциальная точка (pHи, Eи) — значение pH и соответствующая ему ЭДС, при которых ЭДС системы не зависит от температуры.
Электродные системы (за исключением специальных электродов для сильных кислот и щелочей) делают с изопотенциальной точкой около pH = 7 и ЭДС в пределах +/- 50мВ.
Данные характеристики указываются для каждого типа стеклянного электрода.
Источник: http://himsnab-spb.ru/articles/ph_meters_ph_metry_measurement_of_ph/scheme_and_principle_of_operation_of_ph_meter/
Правила работы с рН-метром
рН-метры используются для определения уровня рН в гидропонных растворах. Применяют жидкие измерители рН, лакмусовые бумажки, а также электронные рН-метры. Если с первыми двумя способами измерения кислотности раствора все достаточно просто, то последний может вызвать некоторые затруднения.
Дело в том, что рН-метр работает благодаря стеклянному электроду. А он имеет не особенно приятное свойство — от длительного хранения, если измерительный прибор не используют, электрод меняет свои свойства, и показания рН-метра становятся недостоверными, с отклонением порядка 0,3 — 0,5 единиц. Таким образом, рН-метр нуждается в правильном хранении, правильной калибровке и аккуратном обращении.
Как хранить рН-метр?
Поскольку для содержащегося в метре электрода бездействие и пересыхание губительны, то хранить устройство лучше всего либо в дистиллированной воде, либо в воде с кислотностью около 3-4 единиц.
Хранение рН-метра без водной среды приводит к тому, что показания прибора становятся недостоверными уже через 3-4 недели, отклонение показателей становится со временем все больше.
Таким образом, если хранить рН-метр неправильно, то придется часто заниматься калибровкой, чтобы устройство вновь стало правильно отражать картину.
Однако калибровка требуется время от времени даже при правильном хранении и, тем более, когда устройство только куплено, ведь какое-то время оно уже пролежало на складе.
Калибровка рН-метра
Как было сказано выше, рН-метр так или иначе время от времени нуждается в калибровке. Обычно при проведении разнообразных химических исследований эту процедуру делают 2 раза в месяц. Но для измерения рН питательного раствора в домашней гидропонной установке достаточно проводить калибровку раз в 2-3 месяца, если прибор хранится правильно.
Перед калибровкой нужно поместить устройство в дистиллированную воду на 24 часа.
Для процедуры используют вещество фиксанал с определенным уровнем рН, которое следует растворить в дистиллированной воде. Делают это обычно следующим образом. В стеклянную колбу устанавливают воронку, в ней аккуратно вскрывают ампулу с фиксаналом, а затем смывают его со стенок воронки дистиллированной водой. Воду доливают до отметки «1 литр». Таким образом, в колбе появляется раствор для калибровки, которому необходимо дать отстояться в течение часа. Можно использовать и готовый калибровочный раствор.
Калибровка одноточечного рН-метра
Одноточечные устройства калибруются следующим образом. Для них используется фиксанал с рН 6,86. Посредством вращения винта, погрузив метр в раствор, добиваются совпадения показаний рН-метра с уровнем рН раствора для калибровки.
Калибровка двухточечного рН-метра
Двухточечное устройство отличается от одноточечного тем, что дает более точные показания, так как его можно настроить гораздо точнее. Как понятно из определения таких приборов, настройка осуществляется не по одной, а по двум точкам, что и делает такой прибор более точным.
Калибровать такой рН-метр нужно в два этапа. Сначала — так же, как одноточечный. Затем— по второй точке, по линии соответствия. Соответственно, используются два настроечных винта.
Как правильно использовать рН-метр?
Использовать рН-метр гидропонисту приходится достаточно часто, так как нередко, в связи с разными факторами, меняется уровень рН в питательной среде. Перед каждым измерением необходимо сделать забор питательного раствора из резервуара с помощью шприца или просто чистой посуды (ковшика). Отобранный раствор наливают в чистую емкость и опускают туда же электрод рН-метра. Показания на дисплее прибора будут меняться, но через несколько секунд цифры остановятся. Это и есть правильные показания.
После измерения рН-метр следует хорошо промыть чистой водой, а заем поместить на хранение в колбу с водой дистиллированной.
Альтернативные способы измерения pH
Для замера показателя рН питательного раствора можно взять жидкий реагент, например, жидкий рН-тест GHE. Он показывает результат в диапазоне от 4 до 8,5. Достаточно капнуть 2-3 капли жидкого теста в анализируемую среду, встряхнуть и оценить полученный цвет по таблице. Данного средства хватает для проведения 500 тестов.
Как скорректировать кислотно-щелочной баланс?
Если прибор или жидкий тест показал отклонение pH в сторону кислотной или щелочной среды, его можно выровнять при помощи препаратов-регуляторов, такие как регулятор рH-UP и рH-DOWN. Первые понижают уровень кислотности, вторые – повышают. В продаже есть средства в сухом виде и жидком.
https://www.youtube.com/watch?v=GaIAIyNZPOw
Уникальной формулой на основе концентрированных кислот обладает жидкий регулятор pH Down E-Mode. Препарат бережно и постепенно снижает уровень рН. Допускается применение регулятора с активаторами роста, биодобавками, удобрениями.
Источник: https://agrodom.com/advice/pravila-raboty-s-rn-metrom/
pH-метр
рН-метры в основном являются приборами, предназначенными для определения величины рН и окислительно — восстановительных потенциалов водных растворов, а также для использования в качестве высокоомного милливольтметра.
Прибором можно производить измерения как методом отбора проб с помощью входящих в комплект датчиков, так и непосредственно в лабораторных установках.
Приборы рассчитаны для использования в научно-исследовательских учреждениях, промышленных предприятиях и различных отраслях народного хозяйства.
На производстве в основном используются рН-метры типа рН-210, рН-215 и др., а также иономеры, предназначенные для определения активности одно- и двухвалентных анионов и катионов (величины рХ) в водных растворах, типа И-120, И-130, И-135 и др.
Принцип измерения величины рН
Для измерения величины рН используется потенциометрический метод анализа, который основан на использовании зависимости электрического сигнала (потенциала) специального датчика, называемого измерительным электродом, от состава анализируемого раствора. Измерительный электрод реагирует на ионы водорода, а его потенциал зависит от содержания этих ионов в растворе и подчиняется уравнению Нернста:
Е = Е0 + R×T/F×ln aн = Е0 — 2,3×R×T/F×рН,
где R — универсальная газовая постоянная, равная 8,315 × 107 эрг/C×моль;
Т — температура раствора, К;
F — 96000 кулон/г экв (число Фарадея );
ан — активность ионов водорода в растворе;
рН — величина рН раствора;
Е0 — потенциал стеклянного электрода по отношению к стандартному водородному электроду при ан=1.
Абсолютную величину потенциала в настоящее время измерить невозможно, однако можно измерить потенциал относительно другого электрода, потенциал которого не зависит от состава раствора и условно равен нулю. Такой электрод называется электродом сравнения или вспомогательным электродом.
Таким образом, измерения всегда проводятся при помощи двух электродов: измерительного и электрода сравнения. Кроме того, в настоящее время существуют комбинированные электроды, которые в одном корпусе содержат оба электрода и измерительный, и сравнительный.
Кроме того следует знать, что электродная функция зависит от температуры раствора. Эта зависимость показана на графике.
С увеличением температуры увеличивается наклон (крутизна) электродной характеристики.
Концентрация анализируемых ионов, при которой потенциал электрода не зависит от температуры, называется изопотенциальной точкой.
Значения концентрации раствора и потенциала электрода в этой точке называют координатами изопотенциальной точки.
Для стеклянных электродов координаты изопотенциальной точки нормируются, т.е. указываются изготовителем, а для прочих электродов обычно нет. Современные измерительные приборы позволяют автоматически учитывать температурные изменения электродной характеристики (термокомпенсация), для этого в прибор должны быть введены координаты изопотенциальной точки и текущая температура. Последняя может вводиться либо вручную, либо посредством термодатчика, подключенного к прибору.
При выборе электродов, рекомендуется выбирать такой электрод, изопотенциальная точка которого, лежит вблизи средней концентрации анализируемых растворов.
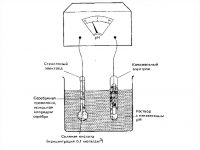
Рассмотрим измерительную систему со стеклянными измерительным и вспомогательным электродами, схема которой приведена на рисунок 1.
Рисунок 1. Схема измерения величины рН раствора.
1 — полый шарик из электродного стекла; 2 — стеклянный электрод; 3 — внутренний контактный электрод; 4 — вспомогательный электрод; 5 — электролитический ключ; 6 — пористая перегородка; 7 — милливольтметр.
При погружении электрода в раствор между поверхностью шарика 1 стеклянного электрода и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях стекла замещаются ионами водорода, и стеклянный электрод приобретает свойства водородного электрода.
Между поверхностью стекла и контролируемым раствором возникает разность потенциалов Ех, величина которой определяется активностью ионов водорода в растворе и его температурой.
Для создания электрической цепи при измерении применяются контактные электроды: внутренний контактный электрод 3, осуществляющий электрический контакт с раствором, заполняющим внутреннюю часть стеклянного электрода, и внешний контактный электрод (вспомогательный электрод) 4, осуществляющий электрический контакт с контролируемым раствором.
Для защиты от воздействия высоких температур (при измерении рН растворов, температура которых выше температуры окружающего воздуха) вспомогательный электрод помещают вне контролируемого раствора и связь с ним осуществляется с помощью электролитического ключа 5 – трубки, наполненной раствором хлористого калия и заканчивающейся пробкой со стеклянным волокном 6.
Раствор хлористого калия непрерывно просачивается через стеклянное волокно пробки, предотвращая проникновение из контролируемого раствора в систему электрода 4 посторонних ионов, которые могли бы изменить величину потенциала электрода.
Электродвижущая сила электродной системы равна алгебраической сумме потенциалов контактов электродов Ек и Евсп потенциала, возникающего на внутренней поверхности стеклянного электрода и определяемого величиной рН внутреннего раствора Евн и потенциала, возникающего на наружной поверхности стеклянного электрода Ек.
Величины Ек, Евсп, и Евн не зависят от состава контролируемого раствора и меняются только при изменении температуры
Е = Ек + Евсп + Евн + Ех = Е0 — 2,3×R×T/F×рН.
Суммарная электродвижущая сила электродной системы зависит от величины рН раствора.
Измеряя ЭДС электродной системы с помощью милливольтметра, шкала которого градуирована в единицах рН, определяют величину рН контролируемого раствора.
Принцип действия прибора
Электродная система, являющаяся датчиком, имеет большое внутреннее сопротивление, достигающее 500-1000 МОм.
Для измерения ЭДС электродной системы применяется компенсационная схема, позволяющая существенно уменьшить ток, потребляемый от датчика при измерении.
Элементарная схема, поясняющая принцип действия рН-метра, приведена на рисунке 2.
Рисунок 2. Элементарная схема прибора.
ЭДС электродной системы Ех сравнивается с падением напряжения на сопротивлении R, через которое протекает ток Iвых оконечного каскада усилителя. Падение напряжения Uвых на сопротивлении R противоположно по знаку электродвижущей силе Ех, и на вход усилителя подается напряжение: Uвх=Ех-Uвых=Ех-R×Iвых.
Напряжение Uвх преобразуется вибропреобразователем в переменное напряжение, которое затем многократно усиливается и при помощи фазочувствительного детектора вновь преобразуется в постоянное напряжение. Это напряжение управляется током Iвых оконечного каскада усилителя. При достаточно большом коэффициенте усиления усилителя напряжение Uвых мало отличается от ЭДС Ех и благодаря этому ток, протекающий через электроды в процессе измерения ЭДС, весьма мал.
Ток Iвых, протекающий через сопротивление R, пропорционален ЭДС электродной системы и величине рН контролируемого раствора.
Электродная система
Основной характеристикой электродной системы является зависимость ее ЭДС от величины рН и температуры раствора. В общем случае ЭДС может быть выражена уравнением:
Е=Еи-[S20+а(t-20)] (рН-рНи),
где Е — ЭДС в милливольтах;
t — температура электродов;
рН — величина рН раствора;
рНи — величина рН раствора, соответствующая изопотенциальной точке;
S20 — крутизна характеристики в изопотенциальной точке;
а — температурный коэффициент крутизны.
Зависимость ЭДС электродной системы рН и температуры может быть представлена следующим приближенным уравнением:
Е=-33-(54,196+0,1884t) (рН-3,28)
Источник: http://kipia-portal.ru/2016/05/31/ph-metr/
2. Принцип работы pH-метра
Анализ процесса термоконтактного крекинга на примере установки непрерывного коксования в псевдоожиженном слое
На установках, термокрекинга и других производствах продолжают эксплуатироваться конструкции печей шатрового типа. Их широкому распространению способствовали простота устройства, легкость обслуживания и удобство проведения ремонтных работ…
Исследование кинетики реакции алкилирования изобутана изобутиленом до изооктана методом математического моделирования
2.3.4 Принцип работы установки для алкилирования изобутана изобутиленом
В алкилатор 4 (в первую секцию слева) поступают жидкий изобутан, оборотная и свежая серная кислота; в каждую секцию подают жидкий изобутилен. За счет выделяющегося тепла часть избыточного изобутана испаряется; его пары попадают в емкость 2…
Источники света в атомно-абсорбционном анализе
fПринцип и схема метода
Свободные атомы элементов, находящиеся в слое нагретого газа- плазмы, обладают способностью селективно поглощать свет…
Кинетика химических реакций
13.2 Принцип Ле Шателье
Состояние химического равновесия при неизменных внешних условиях может сохраняться сколь угодно долго. В действительности же реальные системы обычно испытывают различные воздействия (изменение температуры…
f2. Принцип изотахофореза
При «классическом» электрофорезе разделяемые ионы находятся в однородном электрофоретическом буфере и движутся в электрическом поле с разными скоростями. В условиях изотахофореза все ионы перемещаются с одной и той же скоростью…
Очистка воды гиперфильтрацией
fПринцип работы водоочистных систем, работающих на основе процесса обратного осмоса
Принцип работы водоочистных систем, работающих на основе процесса обратного осмоса, показан на рисунке 4. В одну часть сосуда, разделенного полупроницаемой мембраной, под давлением поступает водный раствор большой концентрации…
Понятие и биологическая роль ферментов
2.1 Принцип действия ферментов
Вещество, подвергающееся превращению в присутствии фермента, называют субстратом. Субстрат присоединяется к ферменту…
Приборы для измерения параметров воды
2.3 Принцип работы дифференциального (автоматического) титрометра
Для начала рассмотрим принцип работы ручного дифференциального титрометра. Для проведения дифференциального титрования используются два идентичных индикаторных электрода, один из которых экранирован от массыраствора…
Принципы работы химических источников тока
f2. Принцип работы аккумуляторной батареи
В настоящее время выпускаются следующие типы электрических аккумуляторов: свинцово-кислотные, щелочные железо-никелевые, кадмий-никелевые и серебряно-цинковые аккумуляторы…
Расчет ректификационной установки для разделения бинарной смеси этиловый спирт-вода
f1.2 Принцип работы ректификационного аппарата
Обычно ректификационный аппарат состоит из двух частей: верхней и нижней, каждая из которых представляет собой организованную поверхность контакта фаз между паром и жидкостью. В нижней части исходная смесь взаимодействует с паром…
Структура и деформационно-прочностные свойства изопренового каучука
2.1.1 Принцип метода
Когда луч света интенсивностью I0 падает на исследуемую пробу, то одна часть излучения отражается от поверхности (Ir), другая часть (Is) рассеивается содержащимися в пробе частицами, а третья часть (Ia) поглощается молекулами…
Усовершенствование адресной доставки БАВ к отдельным органам и клеткам-мишеням
f6.Принцип оптимизации технологии
На химических заводах и комбинатах из сырья минерального, растительного или животного происхождения и различных промежуточных продуктов их переработки производят свыше миллиарда тонн в год химической продукции сотен тысяч наименований…
Экстрагирование в системе «жидкость-жидкость» и «жидкость-твердое тело»
Экстракторы. Классификация. Принцип работы
Классификация экстракторов осуществляется исходя из многих факторов. По принципу организации процесса экстракторы бывают непрерывного и периодического действия…
Электрохимические методы анализа
2.1 Принцип метода
Потенциометрический анализ (потенциометрия) основан на измерении ЭДС и электродных потенциалов как функции концентрации анализируемого раствора…
Юстировка дифрактометра с ячейкой высокого давления и исследование диффрактограммы кремния
Принцип работы дифрактометра и метод Дебая — Шеррера
рентгеновский излучение дифрактограмма кристалл Основными элементами любой установки являются источник — транспорт — детектор. Источником рентгеновского излучения в дифрактометре является рентгеновская трубка…
Источник: http://him.bobrodobro.ru/5931
